코오롱생명과학⓵
식약처, 인보사케이주 ‘안전성’ 문제없다…‘왜’ 허가취소식약처, “자료 허위로 제출했다” VS 코오롱생명과학, “그렇지 않다”

(서울=NSP통신) 강은태 기자 = 식약처는 지난 5월 28일 코오롱생명과학(102940)의 무릎골관절염 치료에 사용되는 유전자치료제 인보사케이주의 판매 허가를 취소하며 전문가 자문결과 ‘안전성에는 문제가 없다’는 다소 이율배반(二律背反)적인 결과를 발표했다.
당시 식약처의 발표는 인보사케이주는 ▲세포사멸시험(2019년 4월11일~5월 26일)을 통해 세포가 더 이상 생존하지 않은 점을 확인했다는 점 ▲임상 시험자에 대한 장기 추적 관찰결과 약물과 관련된 중대한 부작용이 없었다는 점 ▲전문가 자문(2019년 4월 9일~4월 11일) 결과 등을 종합해 볼 때 현재까지 인보사케이주에 대한 안전성에는 큰 우려가 없는 것으로 판단하고 있다는 것.
그러나 식약처는 인보사케이주 인허가 당시 코오롱생명과학이 제출한 서류에 인보사케이주 2액은 신장유래세포인데 이를 연골 유래세포로 ‘명칭’을 속였기 때문에 ‘허가 취소는 당연하다’고 주장했다.
하지만 이 같은 식약처의 발표는 ▲실제 약품은 문제가 없다고 하면서 허가는 취소한 것이어서 왜 약품에 문제가 없는데 허가를 취소하는지 그 배경과 함께 ▲만약 식약처가 코오롱 생명과학으로부터 속은 것이라면 식약처의 인허가 제품 중 다른 약품들은 안전한가라는 심각한 의문을 갖게 했다.
따라서 NSP통신은 인보사케이주를 둘러싸고 대립중인 양측의 입장을 들어보고 ⓵식약처의 허가 취소 처분은 정당했는지 ⓶인보사케이주의 안전성에 대한 진실은 무엇인지 ⓷최근 상장폐지 위기에 몰린 인보사케이주의 개발사 코오롱티슈진의 향후 전망에 대해 총 3회에 거처 보도하며 그 첫 기사로 ‘[코오롱생명과학①]식약처, 인보사케이주 안전성 문제없다…왜 허가취소’를 내보낸다.〈편집자주〉
◆식약처, “코오롱생명과학에 속았다”
식약처 관계자는 본지와의 인터뷰에서 인보사케이주에 대해 “임상실험은 방법을 제약회사가 (식약처에) 제출하며 약의 효과성과 안전성을 검증할 수 있는 유효한 방법이라고 인정될 때 (식약처가) 임상실험을 허가해준다”고 말했다.
이어 “(그리고 제약회사가) 임상실험 한 뒤 임상실험까지 자료를 마쳤다라고 자료를 (코오롱생명과학이 식약처에 자료를) 제출하게 되는데 거기서 코오롱이 자료를 허위로 제출했다”고 강조했다.
또 식약처 관계자는 “코오롱 인보사(케이주)라는 약이 1액과 2액으로 나뉘어져 있고 개그 폴(gag · pol)이 나오면 신장 유래세포이고 안 나오면 신장 유래세포는 아니라고 볼 수 있는데 코오롱이 (식약처를) 속인 것은 2액을 시험 했는데 그중에서 실험 조작 미스 등의 경우로 개그 폴 세포가 안 나올 수 있고 21번의 실험 중 2번의 실험에서 안 나왔는데 안 나온 2번 만 제출을 했고 그것은 신장 유래세포가 아닌 것처럼 보인 위한 것이다”고 지적했다.
이어 “둘째는 1액과 2액을 특징을 비교하는 실험이 있는데 1액도 연골세포이고 2액도 연골세포이면 두 액의 발현 상태가 유사해야 한다. 그런데 두 세포사이에 발현성이 유사한 자료를 냈는데 그 자료는 1액과 2액을 비교한 자료를 낸 것이 아니라 1액과 1~2액을 혼합한 자료를 비교했다, 다시 말해 비유를 들자면 소주와 맥주를 비교해야 되는데 맥수와 소맥을 비교한 것이다, 소맥은 맥주랑 비슷하지만 소주와 맥주는 맛과 색깔도 다르다. 이것이 코오롱이 허위로 낸 자료다”고 비판했다.
하지만 식약처가 코오롱으로부터 속았다면 임상실험 결과를 포함한 인보사케이주의 인허가 당시 식약처가 검증을 철저히 하지 못한 잘못은 인정하느냐는 본지의 질문에 대해 식약처 관계자는 “식약처가 완벽하게 잘못은 없다라고 말할 수는 없고 속은 것도 자랑은 아니다”며 “ 그러나 객관적인 진실은 속은 거고 그러려면 설명이 많이 필요하다”고 해명했다.
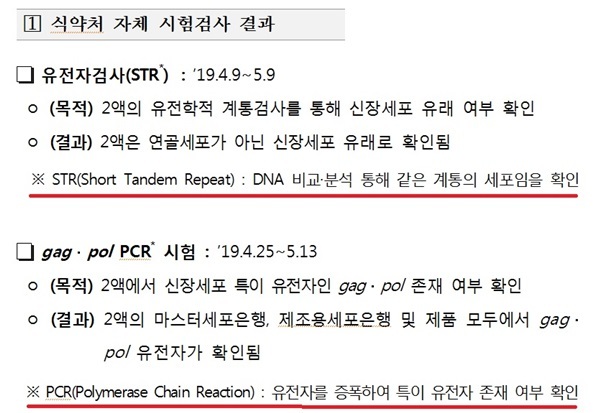
이어 “우리나라의 평균 신약 개발비(심사비)가 약 400만원이다 허가 낼 때 심사비가 그러는데 미국은 1억에서 10억 원 간다. 우리도 10억 원을 받으면 모든 것을 검사해 볼 수 있다”며 “ STR이라는 비싼 검색기도 들여오고 그래서 이번 인보사 사태 이후로 그런 대책마련을 위해 검사 인력을 늘리고 예산을 늘리고 장비를 도입하자 이런 노력을 추진하고 있다”고 설명했다.
◆코오롱생명과학, “그렇지 않다” 반박
식약처 관계자의 ‘코오롱생명과학이 식약처에 허위자료를 제출했다’ ‘속였다’라는 주장에 대해 코오롱생명과학은 “그렇지 않다”며 “식약처를 속인적도 허위 자료를 제출한 적도 없다”고 반박했다.
현재 코오롱생명과학 측은 “코오롱 티슈진이 세포은행으로부터 구매해 인보사케이주를 개발한 제조용 세포 GP2-293세포가 연골유래세포가 아니라 신장유래세포라는 사실은 올해 초 코오롱 티슈진이 알려와 처음으로 알았고 그 점은 식약처에 보고했다”며 “인허가 받을 당시 인보사케이주를 개발한 제조용 세포 GP2-293세포가 바꿔치기 되거나 변경된 적은 단 한번 없다”고 설명했다.
이어 “코오롱은 제조용 세포 GP2-293세포에 두 가지의 플라스미드(Plasmmid)바이러스로 형질 변경 등 여러 가지 과정을 거처 TGF-ß1 단백질을 생성했고 TGF-ß1 단백질은 코오롱 티슈진이 통하기 전까지 연골유래 세포로 알고 있었고 이점은 식약처 인허가 당시부터 현재까지 변한 사실을 없기 때문에 식약처를 속인 적이 없다”고 강조했다.
특히 코오롱생명과학 측은 “식약처도 스스로 인정하듯 현재까지 인보사케이주에 대한 세포사멸시험(2019년 4월11일~5월 26일)을 통해 세포가 1~2주 사이 사멸하고 44일 후 완전히 사멸하는 것을 획인 했고 임상 시험자에 대한 장기 추적 관찰결과 약물과 관련된 중대한 부작용이 없었다는 점과 전문가 자문결과 등을 종합해 볼 때 현재까지 인보사케이주에 대한 안전성에는 큰 우려가 없다고 확인하고도 신장유래세포를 연골유래세포로 알고 명칭을 잘못 기재한 것을 근거로 허가를 취소하는 것은 납득하기 어렵다”며 억울해 했다.

한편 코오롱생명과학은 인보사케이주에 대한 품목허가를 2016년 7월 8일 신청했고 약 1년 후인 2017년 7월 12일 식약처로부터 품목 허가를 취득해 사실상 인보사케이주 2액의 TGF-ß1 단백질에 신장유래세포를 확인할 수 있는 검사인 STR 검사(Short Tandem Repeat, 유전학적 계통검사)는 미국에서도 정책변화로 2017년 3월 시작돼 코오롱티슈진 연구원들이 2018년 이전에는 STR 검사 기법을 잘 알지 못한 것으로 전해졌다.
NSP통신 강은태 기자 keepwatch@nspna.com
저작권자ⓒ 한국의 경제뉴스통신사 NSP통신·NSP TV. 무단전재-재배포 금지.
![[NSPAD]삼성전자](https://file.nspna.com/ad/T01_samsung_3842.gif)
![[NSP7컷]인터넷은행의 혁신적인 배신 [NSP7컷]인터넷은행의 혁신적인 배신](https://file.nspna.com/news/2023/05/30/photo_20230530123951_639759_0.jpg)
![[NSP PHOTO][업앤다운]제약주 하락…씨엔알리서치↑·퓨쳐메디신↓](https://file.nspna.com/news/2024/04/19/20240419160648_694308_0.jpg)
![[NSP PHOTO][업앤다운]은행주 하락…제주은행↑·DGB금융↓](https://file.nspna.com/news/2024/04/19/20240419155900_694300_0.jpg)
![[NSP PHOTO][금융업계기상도]NH농협은행 흐림·카카오뱅크 맑음](https://file.nspna.com/news/2024/04/19/20240419142349_694265_0.jpg)
![[NSP PHOTO][들어보니]인터넷은행 등 가상계좌 악용 청소년 범죄↑…은행권 작정하고 속이면 심사통과](https://file.nspna.com/news/2024/03/18/20240318130327_688317_0.jpg)
![[NSP PHOTO][들어보니]홍콩ELS 0~100% 배상안에 은행권 차라리 신속히 이사회 설득해야](https://file.nspna.com/news/2024/03/11/20240311140210_687034_0.jpg)
![[NSP PHOTO][들어보니]우리금융, 소형 포스증권 인수, 오히려 장점…증권계 시너지는 두고봐야](https://file.nspna.com/news/2024/02/26/20240226155743_684667_0.jpg)
![농협은행[N06] [NSPAD]농협은행](https://file.nspna.com/ad/N06_nhbank_3960.jpg)
![KB국민카[N06] [NSPAD]KB국민카](https://file.nspna.com/ad/N06_KBCARD_3957.jpg)
![KT텔레캅[N06] [NSPAD]KT텔레캅](https://file.nspna.com/ad/N06_kttelecap_3956.png)
![한국부동산원[N06] [NSPAD]한국부동산원](https://file.nspna.com/ad/N06_hankukgam_3940.jpg)
![우리카드[N06] [NSPAD]우리카드](https://file.nspna.com/ad/N06_wooricard_3934.png)
![한미약품[N06] [NSPAD]한미약품](https://file.nspna.com/ad/N06_hanmi_3916.jpg)
![신한카드[N06] [NSPAD]신한카드](https://file.nspna.com/ad/N06_shinhancard_3910.jpg)
![종근당[N06] [NSPAD]종근당](https://file.nspna.com/ad/N06_jonggdang_3902.png)
![KB국민은행[N06] [NSPAD]KB국민은행](https://file.nspna.com/ad/N06_kbstar_3901.jpg)
![하나은행[N06] [NSPAD]하나은행](https://file.nspna.com/ad/N06_hanagroup_3900.png)
![스마일게이트[N06] [NSPAD]스마일게이트](https://file.nspna.com/ad/N06_smilegate_3893.jpg)
![조이시티[N06] [NSPAD]조이시티](https://file.nspna.com/ad/N06_joycity_game_3892.jpg)
![상상인저축은행[N06] [NSPAD]상상인저축은행](https://file.nspna.com/ad/N06_sangsangin_3891.jpg)
![LG유플러스[N06] [NSPAD]LG유플러스](https://file.nspna.com/ad/N06_uplus_3890.png)
![우리은행[N06] [NSPAD]우리은행](https://file.nspna.com/ad/N06_wooribank_3886.jpg)
![동아쏘시오홀딩[N06] [NSPAD]동아쏘시오홀딩](https://file.nspna.com/ad/N06_doasosio_3873.jpg)
![OK저축은[N06] [NSPAD]OK저축은](https://file.nspna.com/ad/N06_oksaving_3872.png)
![[NSP PHOTO][금융업계기상도]하나은행 맑음·NH농협은행 구름조금](https://file.nspna.com/news/2024/04/12/20240412144420_693025_0.jpg)
![[NSP PHOTO][금융업계기상도]하나은행 맑음·NH농협은행 구름조금](https://file.nspna.com/news/2024/04/05/20240405143550_692083_0.jpg)
![[NSP PHOTO]금통위, 서영경·조윤제 떠나고 이수형·김종화 온다](https://file.nspna.com/news/2024/04/19/photo_20240419115608_694212_0.jpg)
![[NSP PHOTO]오는 30일 태영건설 기업개선계획 의결](https://file.nspna.com/news/2024/04/18/photo_20240418170553_694129_0.jpg)
![[NSP PHOTO]중동 분쟁 관련 금감원 중기·서민 사전적 채무조정 지원 적극 실시](https://file.nspna.com/news/2024/04/18/photo_20240418161407_694096_0.jpg)
![[NSP PHOTO]NH농협은행 흐림·카카오뱅크 맑음](https://file.nspna.com/news/2024/04/19/photo_20240419142349_694265_0.jpg)
![[NSP PHOTO]KB금융, 계열사간 고객센터 연계 상담 서비스 오픈](https://file.nspna.com/news/2024/04/19/photo_20240419113803_694200_0.jpg)
![[NSP PHOTO]중동사태까지, 고금리 길어진다…금융당국 수장 운명 관심](https://file.nspna.com/news/2024/04/18/photo_20240418175904_694159_0.jpg)
![[NSP PHOTO]24년 1Q 美 모바일게임 수익 64억달러 기록…팬데믹 이후 사상최고치 경신](https://file.nspna.com/news/2024/04/18/photo_20240418134250_694001_0.jpg)
![[NSP PHOTO]넷마블 다크 판타지 콘셉트 레이븐2 5월말 출시…AAA급 퀄리티·차별화된 액션 쾌감 특징](https://file.nspna.com/news/2024/04/18/photo_20240418122150_693965_0.jpg)
![[NSP PHOTO]코웨이 물빛소리 합창단, 장애인의 날 기념 마음을 울리는 하모니 공연](https://file.nspna.com/news/2024/04/19/photo_20240419173432_694361_0.jpg)
![[NSP PHOTO]스테이지엑스, 준비법인 스테이지엑스 설립 시작…자본금 2000억원 규모](https://file.nspna.com/news/2024/04/19/photo_20240419151343_694286_0.jpg)
![[NSP PHOTO]현대건설, 1분기 영업이익 2509억 원…전년 동기比 44.6%↑](https://file.nspna.com/news/2024/04/19/photo_20240419141310_694261_0.jpg)
![[NSP PHOTO]LG전자, 공감지능 AI 에어컨 판매량 증가…휘센 AI 에어컨, 올해 1Q 판매량 전년比 약 30%↑](https://file.nspna.com/news/2024/04/19/photo_20240419130425_694237_0.jpg)
![[NSP PHOTO][타보니]2025년형 트랙스 RS, 163.6km주행에 연비 14.2km/ℓ…빠른 반응속도는 덤](https://file.nspna.com/news/2024/04/19/20240419153707_694293_0.jpg)
![[NSP PHOTO][타보니]볼보 XC90 B6, 스웨디시 력셔리 보여준 플래그십 SUV](https://file.nspna.com/news/2024/04/18/20240418151202_694054_0.jpg)
![[NSP PHOTO][타보니]렉서스 NX 450h+ F SPORT, 승차감 좋은 연비갑 SUV](https://file.nspna.com/news/2024/04/04/20240404170153_691942_0.jpg)